|
- Home
- BioZoom
- BioZoom archives
- 2017
- 2017 Issue 4
- Immunterapi i behandling af kræft
Immunterapi i behandling af kræft |
Forfatter: Inge Marie Svane, Professor, overlæge, centerleder, Center for Cancer Immunterapi – CCIT, Onkologisk og Hæmatologisk afdeling, Herlev Hospital, Københavns Universitet, inge.marie.svane@regionh.dk
|
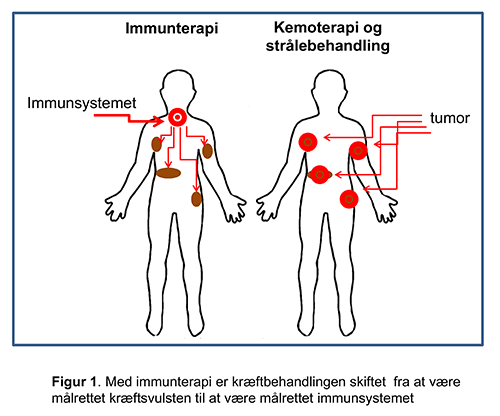
Immunterapi er en ny måde at tænke cancerbehandling på, hvor behandlingen er rettet mod immunsystemet og ikke direkte mod cancercellerne. Mange typer immunterapi som cytokiner, cancervacciner, cellulære immunterapier og antistoffer har været testet i kliniske forsøg gennem de seneste årtier. Cancer immunterapi aktiverer immunsystemet til at bekæmpe kræften, hvilket kan medføre markante behandlingsresultater, men også helt nye former for bivirkninger. Immunterapi er i centrum af fremtidens kræftbehandlingKræftbehandling udgør et vigtigt sundhedsområde, som har stor bevågenhed fra såvel befolkning, sundhedspersonale, patientforeninger som politikere. De betydelige fremskridt, der aktuelt finder sted inden for kræftbehandlingen sker i høj grad inden for immunterapien. Udviklingen har taget fart over de seneste par år og betyder, at vi snart kan behandle en meget stor gruppe kræftpatienter med vidt forskellige kræftsygdomme langt mere effektivt end hidtil ved anvendelse af immunterapi. Aktuelt bliver nye former for immunterapi godkendt i hastigt tempo til stadigt flere forskellige kræftformer. De nye behandlingsmæssige muligheder varsler, at den generelle overlevelse ved mange forskellige kræftsygdomme kan forbedres markant og flere patienter, selv med spredning af sygdommen, vil kunne blive helt sygdomsfri. Immunterapien vil således komme til at udgøre en vigtig søjle i fremtidens kræfthandling, og det må forudses at medføre ændringer i behandlingsstrategierne for de fleste, hvis ikke alle, kræftformer henover de næste år. Et konceptuelt brud med klassiske kræftbehandlingsprincipperImmunterapien repræsenterer en helt ny måde at tænke cancerbehandling på, hvor fokus for behandlingen primært er immunsystemet og ikke direkte cancercellerne (Figur 1). Princippet bygger på nyere viden om de immunologiske virkningsmekanismer; behandlingen har til hensigt at manipulere med den immunologiske ligevægt med det formål at eliminere cancercellerne. Med andre ord virker cancer-immunterapi ved at aktivere immunsystemet til at bekæmpe kræften, hvilket kan medføre markante behandlingsresultater, men også tilfælde af helt nye former for bivirkninger, som sundhedspersonalet skal kunne håndtere.
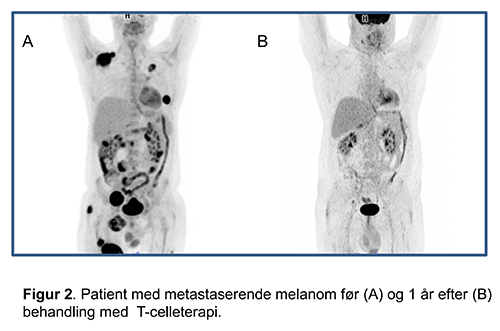
Figur 1. Med immunterapi er kræftbehandlingen skiftet fra at være målrettet kræftsvulsten til at være målrettet immunsystemet. Mange typer immunterapi som eksempelvis cytokiner, cancervacciner, cellulære immunterapier og antistoffer har været testet i kliniske forsøg gennem de seneste årtier. Gennembruddet på immunterapi-området åbner op for et helt nyt kapitel inden for behandling af cancer og har betydet en stor satsning på dette forskningsområde internationalt. Ikke kun er nye immunregulerende og cellulære terapier under udvikling, men også mange nye kombinationsmuligheder er under afprøvning. Immunregulerende antistofferEn måde hvorpå tumorceller tilegner sig en form for resistens over for immunsystemet og undslipper ’immune surveillance’ er gennem dysregulering af de såkaldte checkpoints i de immunregulerende signaleringsveje. Under normale fysiologiske forhold er disse signaleringsveje altafgørende for, at immunreaktioner mod patogener kan effektueres under samtidig beskyttelse mod autoimmunitet og vævsbeskadigelse. De første checkpoints, der er testet som behandlingsmål er CTLA-4 og PD-1, der udøver regulerende funktioner i forskellige stadier af et immunrespons. CTLA-4 udtrykkes primært på naive T-celler. Gennem interaktion med CD80 og CD86 på de antigenpræsenterende celler hæmmer CTLA-4 mulige autoreaktive T-celler i initieringsfasen af naiv T-celleaktivering. PD-1 udtrykkes primært på aktiverede T-celler, mens dens ene ligand PD-L1 hovedsageligt er udtrykt på antigenpræsenterende celler, men ofte også i høj grad på tumorceller. Interaktion mellem PD-1 og PD-L1 fører til hæmning af de aktiverede T-celler og hindrer derved tumordrab. Antistoffer, der blokerer CTLA-4 og PD-1/PDL1 checkpoints, har vist klinisk effekt på flere cancertyper og er på nuværende tidspunkt godkendt som standardbehandling til patienter med metastatisk sygdom fra modermærke-, lunge-, hoved-hals-, blære- og nyrekræft. Monoterapi er stadig det mest anvendte (effektrater på 10-40%), men kombinationsterapi, der blokerer begge checkpoints, vinder frem inden for flere kræftformer med øget sygdomseffekt som gevinst (effektrater på 40-60%), men også ofte med øget risiko for alvorlige bivirkninger. Der pågår aktuelt kliniske forsøg, der skal vise, om justering af doser og behandlingsintervaller kan medvirke til at reducere toksiciteten uden at give køb på effekten. Ydermere er en lang række antistoffer og inhibitorer målrettet andre immunologiske checkpoints, f.eks. LAG-3 og IDO, under udvikling. Flere af disse har i tidlige forsøg vist tegn på klinisk effekt enten alene eller i kombination med anti-PD1. Nogle af disse nyere kombinationer synes at være lige så effektive, men mindre bivirkningsfulde end kombinationen af CTLA-4 og PD-1 antistoffer, men større kliniske forsøg skal gennemføres, før de kan bringes i klinisk anvendelse. Hidtil er de immunregulerende antistoffer testet på patienter med metastaserende cancersygdom, men for nyligt fremkom de første data, der viser, at de også kan have forebyggende virkning mod tilbagefald (melanom) og som konsoliderende behandling efter primær kemo-radioterapi (lungekræft). Disse resultater åbner op for et langt bredere anvendelsesområde for immunterapien, der på sigt kan betyde, at tusindvis af cancerpatienter kan have gavn af adjuverende immunterapi. Da immunregulerende antistoffer overordnet virker ved at stimulere patientens immunrespons, ses der ikke overraskende immunrelaterede bivirkninger. CTLA-4 antistofferne forårsager flere bivirkninger end PD-1/PD-L1 antistofferne, og kombinationen af disse giver betydeligt flere alvorlige bivirkninger. Især pneumonitis, colitis, endokrin toksicitet samt dermatitis er hyppige. Håndtering af bivirkninger består primært i immunsuppression ved anvendelse af prednisolon. Adoptiv T-celleterapiTumorer er ofte infiltrerede af store mængder af T-celler, såkaldte tumorinfiltrerende lymfocytter (TILs). T-celleterapi baseret på ekspansion af TILs er en eksperimentel behandling, der består af intravenøs infusion af milliarder af T-celler; oprindelig isoleret fra patientens tumor og derefter ex-vivo opformeret og aktiveret. Behandlingen forudgås af højdosis lymfodepleterende kemoterapi med det formål kortvarigt at eliminere irrelevante og immunsupprimerende celler i kroppen. Efter infusion af T-cellerne behandles patienten med det immunaktiverende stof IL-2. Behandlingen er intensiv, og alle patienter oplever behandlingskrævende bivirkninger på baggrund af højdosis kemoterapi og efterfølgende højdosis IL-2. I de tidlige studier anvendtes såkaldte ‘selected TILs’, som er T-celler udvalgt på baggrund af påvist antitumor-aktivitet. Det tager dog relativt lang tid at producere disse T-celler (6-8 uger), og gevinsten er tvivlsom. I de senere studier anvendes i stedet såkaldte ‘young TILs’. Her anvendes alle T-cellekulturer uden forudgående testning. Metoden giver ophav til T-celler med en yngre fænotype og reducerer patientfrafaldet pga. kortere produktionstid (4-6 uger). På verdensplan er flere hundrede melanompatienter behandlet med T-celle-terapi inden for rammerne af fase I og II kliniske forsøg med effekt-rater på 20-70%. På Center for Cancer Immunterapi (CCIT, https://www.herlevhospital.dk/ccit-denmark/) har vi forsket i behandling med TILs primært i patienter med metastatisk modermærkekræft, hvor vi har set respons hos 40% af de behandlede patienter samt forlænget overlevelse (Figur 2).
Figur 2. Patient med metastaserende melanom før (A) og 1 år efter (B) behandling med T-celle-terapi. Med henblik på at opnå godkendelse af T-celle-terapi som standardbehandling har CCIT i samarbejde med et hollandsk cancercenter igangsat et randomiseret fase III studie. Det er desuden oplagt at forsøge at udbrede T-celle-terapi til andre cancerformer. På CCIT pågår klinisk afprøvning af T-celle-terapi til patienter med metastatisk ovariecancer og nyrecancer. Andre mulige kræftformer er sarkomer, lungecancer, hoved-hals cancer og HPV-associerede cancere. CCIT undersøger desuden aktuelt effekten af T-celle-terapi i kombination med BRAF hæmmer og i kombination med checkpoint antistoffer i mindre pilotstudier. CAR-T celleterapiAnvendelse af genetisk modificerede T-celler er baseret på det rationale, at T-cellers evne til at genkende cancerceller kan styres ved genetisk manipulation, hvor T-cellerne transduceres med kimære antigenreceptorer (CARs). CARs kombinerer antistoflignende genkendelse med T-celleaktiverende funktion. Konstruktionen af en CAR afhænger af identifikationen af ??et egnet antistof til targetering af et relevant celleoverflademolekyle med ekspression afgrænset til cancercellerne. CAR-konstrukter er under fortsat udvikling, hvor man supplerer med tilkobling af co-stimulatoriske domæner. CAR-T-cellerne bliver etableret fra T-celler isoleret fra blodbanen og ekspanderes i laboratoriet; inden infusion af flere millioner celler behandles patienterne med lymfodepleterende kemoterapi. CAR-T-celleterapi har primært vist sig at være effektiv mod hæmatologiske B-celle cancere. De lymfoide celler, hvor canceren udgår fra, udtrykker et specifikt antigen (CD19) som man ved hjælp af CARs kan målrette T-cellerne imod. Denne behandling har vist sig yderst effektiv til børn og unge med akut lymfatisk leukæmi (90% komplet remission) og er netop godkendt som standardbehandling. CAR-T-celleterapi mod solide tumorer har hidtil haft begrænset succes. På CCIT pågår aktiviteter mhp. at etablere CAR-T teknologien. Bivirkninger forårsaget af off-tumor toksicitet er primært begrænset til B-celle aplasi, der håndteres med profylaktiske infusioner af immunoglobuliner. Desuden ses ‘cytokine-release-syndrome’, der er en alvorlig medicinsk tilstand udløst af en cytokinstorm. IL-6 ser ud til at være central for syndromet, og håndtering omfatter behandling med en IL-6 receptor agonist. Immunregulerende cancervaccinerVed anvendelse af eksempelvis antigene peptid-vacciner kan man aktivere T-celler via immunisering. Som tidligere beskrevet er immunregulerende checkpoints opreguleret i flere cancertyper, hvorfor de er interessante mål for peptid vaccination. På CCIT har vi påvist T-celler i blodet, som er specifikke mod PD-L1 og det immunhæmmende enzym IDO. Disse T-celler er cytotoksiske og i stand til at dræbe tumorceller og immunhæmmende immunceller, som udtrykker PD-L1 og IDO. På baggrund af dette forsøger vi i samarbejde med spin-out biotek-firmaet IO Biotech ( http://www.iobiotech.com/ ) at udvikle cancervacciner rettet mod PD-L1 og IDO. I et pilotstudie har vaccination med IDO peptider vist lovende klinisk effekt, konsoliderende efter kemoterapi, hos patienter med lungecancer og vaccination med PD-L1 testes aktuelt i patienter med myelomatose. Peptid-vacciner synes generelt at være atoksiske. Vacciner er derfor attraktive kandidater til kombination med anden immunterapi, da de potentielt kan forøge anti-tumor-effekten uden at bidrage til yderligere bivirkninger. På denne baggrund har CCIT påbegyndt et kombinationsstudie til melanompatienter med Nivolumab og PD-L1/IDO peptidvaccine. Artiklens indhold bygger på både international forskning og forskning udført på CCIT, Herlev Hospital . Yderligere læseforslagPardoll, D. M. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer 12, 252–64 (2012). Andersen, R. et al. Long-Lasting Complete Responses in Patients with Metastatic Melanoma after Adoptive Cell Therapy with Tumor-In fi ltrating Lymphocytes and an Attenuated IL2 Regimen. 22, (2016). Fesnak, A. D. et al. Engineered T cells: The Promise and Challenges of Cancer Immunotherapy. Nat Rev Cancer 16, 566–581 (2017). Iversen, T. Z. et al. Long-lasting disease stabilization in the absence of toxicity in metastatic lung cancer patients vaccinated with an epitope derived from indoleamine 2,3 dioxygenase. Clin. Cancer Res. 20, 221–232 (2014). |
Looking for something? Search the website here: |